從醫學院或生科系畢業的新鮮人對臨床試驗專員(Clinical Research Associate,CRA)一職充滿憧憬,認為這是進入生技醫藥產業界的理想起點。然而,CRA的角色並非僅是監督臨床試驗收案進度,背後更涉及法規理解能力、團隊溝通與合作能力、問題解決能力等多元挑戰。
許多初入職場的新鮮人對CRA的職務內容與未來可能面臨的實際情況缺乏深入了解,甚至可能對CRA的高度專業要求存在誤解。為了協助新鮮人做好迎接CRA職涯挑戰的準備,我們特別設計了【臨床試驗專員CRA初階實務培訓班】。
此課程將以深入淺出、圖文並茂的方式,帶領學員洞察臨床試驗管理架構,拆解現行法規規範並詳述團隊成員的組成與職責。有了以上觀念,再進一步釐清CRA的工作職掌,透過案例演練的方式掌握CRA必備的基礎技能。
CRA培訓班已開辦進入第9年,超過1000位學員加入學習行列,當中不少學員更確定了未來挑戰CRA的決心,當然也有不少人因此打消了念頭。打破新鮮人對CRA的迷思,讓大家不僅了解CRA的專業門檻,更具備從容應對未來挑戰的基礎與信心,正是我們持續不間斷開辦此課程的初心。
關於課程
主辦單位:台灣光鹽生物科技學苑
課程地點:線上同步遠距教學 (Microsoft Teams Live Webinar)
【本線上課程未獲得講師授權,故無提供錄影檔,敬請見諒】
課程時間:114年3月22日 (六) 9:00至16:30 (8:30 開放線上直播測試報到)
授課師資:林宜瑩 國際藥廠資深臨床試驗規範經理🔎
授課內容
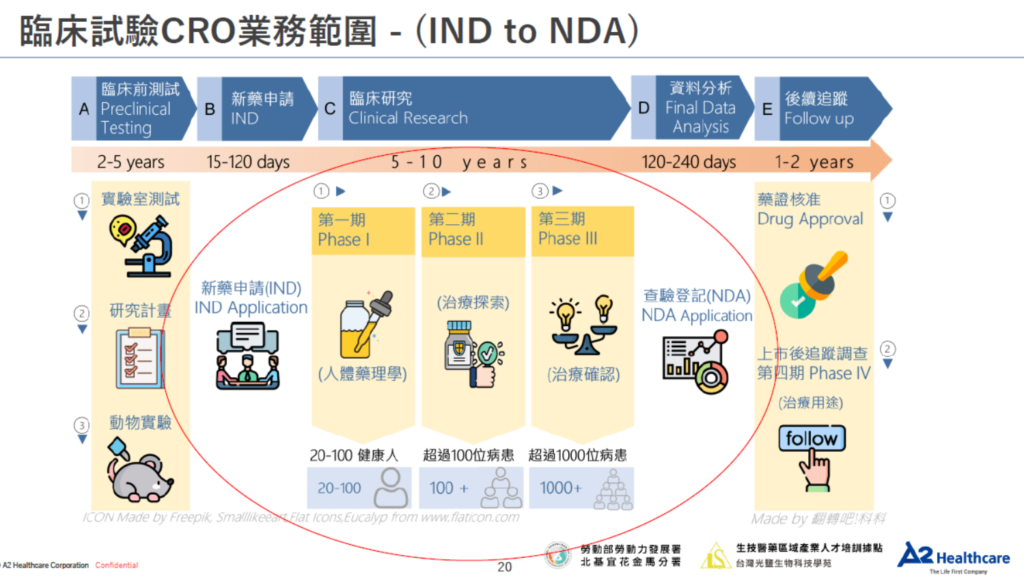
一、台灣臨床試驗的管理與法規環境
- 臨床試驗的定義
- 臨床試驗的申請與審查機制
- 試驗機構的資格認定
- 藥品優良臨床試驗作業準則(GCP)
二、人體試驗委員會
- 人體試驗委員會的組成與審查流程
- 受試者同意書的相關規範
三、臨床試驗的規劃與執行
- 試驗計劃書的內容架構
- 試驗評估時程表
- 受試者招募
四、試驗主持人
- 試驗主持人的資格條件
- 試驗主持人的責任
- 試驗人員授權表
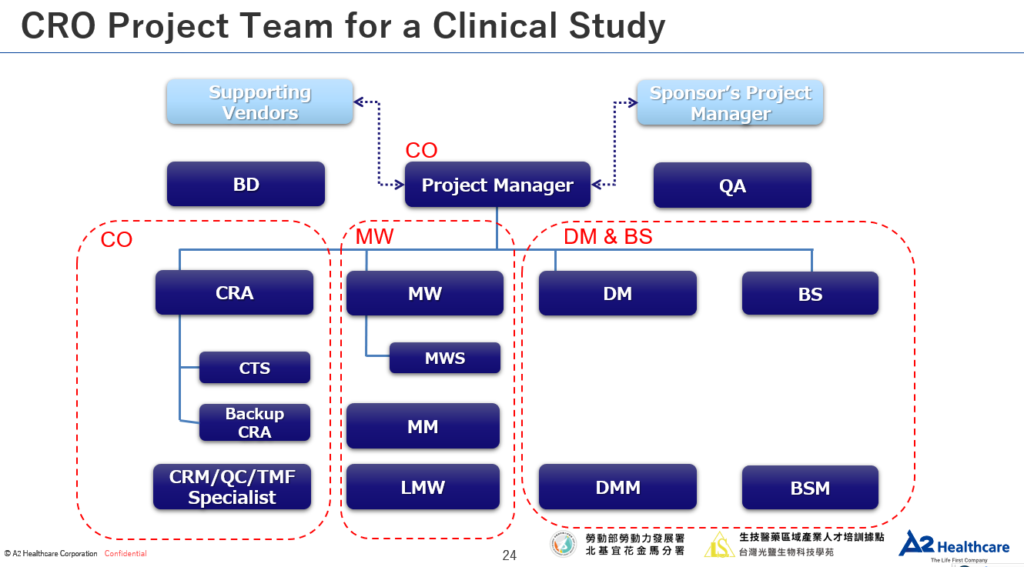
五、試驗委託者
- 試驗委託者(Sponsor)
- 受託研究機構(CRO)
- 監測者(Monitor)
六、為CRA職涯做準備
- CRA的角色定位
- CRA的工作內容與基本條件
- CRA須具備的能力、特質與態度
七、案例演練
- 受試者同意書的送審實務
- 試驗人員授權表
課程收費&報名連結
| 一般報名 | (2/14中午12點截止) | 學生報名 (檢附有效學生證或相關在學證明EMAIL至學苑) |
|---|---|---|
| 3,000元 | 2,500元 | |
*上課達滿時數6小時,並完成課前/課後測驗,使得核發本線上課程結業證書
* 由於線上課程核發之電子證書需設防偽標記及建立專屬識別碼,因此將於課後兩週內連同發票寄送至您的電子信箱
課程特色






講師介紹
林宜瑩
主要經歷:
- 華鼎生技顧問股份有限公司 臨床研究處 臨床試驗經理
- 安成生物科技股份有限公司 臨床研究處 處長
- 安成國際藥業股份有限公司 臨床研究處 經理
- 安成國際藥業股份有限公司 新藥開發處 臨床專案經理
- 台灣諾華股份有限公司 Medical Scientific Liaison(MSL)
- 佳生科技顧問股份有限公司 醫藥學術部 專案經理
-
佳生科技顧問股份有限公司 法規部 專員
相關文章
你可能感興趣?
FAQ
一、如何報名課程?
- 填寫並送出Google報名表單。
- 進入線上繳費系統完成繳費。
- 以上步驟全數完成才視為成功報名。
二、找不到繳費連結怎麼辦?
繳費連結會出現在『報名表單送出界面』。
如果你不小心關閉報名完成頁面,或是事後才想繳費,最後卻找不到繳費連結,以下提供您幾個方式:
- 重新填寫並送出報名表單,再次獲取繳費連結。
- (建議)來信學苑bioschool@biotech-edu.com索取繳費連結。
最好的方式當然是報名+繳費動作一次完成,以防時間過太久忘記繳費而錯過報名期限。
三、公司報帳要注意些什麼?
如您需報帳,可直接於線上繳費系統中輸入公司正確統編,或您可來信學苑告知。(凡發票打抬頭統編者,視為單位/公司付費派訓,結訓證書將署名「xxx單位/公司(統編公司)及學員姓名」,敬請學員自行評估,謝謝。
**特別提醒:如您需開立公司統編及抬頭,請於開課前告知,恕不接受課後進行任何形式的異動。(如有此類異動需求,也請於課前告知並說明原因。)
四、公司報名無法於線上繳費系統作業,是否有提供其他繳費管道?
公司報名作業,如無法於本繳費系統作業者,請來信或來電本學苑洽詢。我們會提供您學苑的銀行帳號,屆時再將費用匯至該帳號,並回信告知轉出帳號末五碼,如需打統編抬頭則可一併告知,使完成報名手續。
五、如何確認有報名成功?
您會在完成繳費後數個工作日內,收到由光鹽寄出的<報名成功通知信件>,收件信箱為您報名時填寫之Email。如遲遲未收到請先至『垃圾郵件』內查找,或可聯繫學苑詢問課程通知進度。
六、報名後何時可以拿到發票及證書?
如為實體課程,發票及證書將於開課日當天發放。請在離開課程會場前,確認姓名、公司抬頭統編是否正確。
如為線上課程,電子發票將於課程結束後寄送至您報名時所留的email,請於報名時確認email正確無誤。(線上課程核發之電子證書需設防偽標記及建立專屬識別碼,程序較為複雜,如有不便煩請見諒)
如您急需開立電子發票或證書,請來信或致電學苑告知原因,我們將協助加快審查程序。
七、如果還有更多問題該怎麼辦?
歡迎於上班時間 : 週一 ~ 週五 09:00 – 18:00
透過以下方式聯繫學苑
- 來信學苑信箱 bioschool@biotech-edu.com
- 致電聯繫專人客服電話 02-2545-9721
- 透過官網「聯絡我們」功能