在全球醫藥和生物技術產業中,法規人員(Regulatory Affairs, RA)扮演著極為關鍵的角色。他們不僅是藥廠與衛生主管機關之間的溝通橋樑,更是推動藥品從研發到上市,乃至後續許可證維護的重要推手。透過對藥品查驗登記等法規制度的深入理解,RA 協助藥廠進行產品的生命週期管理,確保每一步皆符合各國監管機構的法規要求,進而保障民眾的用藥安全與公共健康。
一、藥廠RA的五大核心職責
1. 查驗登記申請與專案管理:
RA 負責新藥或學名藥的查驗登記申請,這是一項結合法規知識與專案管理技能的工作。他們需整合研發、品質、生產、臨床試驗、專利等部門的資料,編撰並提交完整的CTD送審文件給各國主管機關,如台灣TFDA、美國 FDA 或歐盟EMA 等。同時,他們也需掌控取得藥品許可證的時程,確保各項申請如期推進,降低上市時程的延遲風險。
延伸閱讀:


2. 藥證管理(ex.上市後變更、藥證展延…):
藥品一旦上市後,RA 的工作並未結束。產品在市售期間可能因製程改善、包裝更新、原料更換等原因而需要進行「藥證變更登記」申請。此外,藥證屬於有期限的許可文件,RA 必須掌握各項藥證的效期,並於期限內提出展延申請,避免產品因藥證失效而無法販售,競爭對手可藉由此機會搶占市場。
3. 研發策略諮詢:
在藥品研發初期,RA 也能提供關鍵的策略建議。透過了解各個國家或產品市場的法規差異,協助制定符合規範的計畫,包含早期研發實驗數據收集、臨床試驗設計、原料藥及成品的化學製造管制(CMC)技術文件準備等,確保未來能順利完成IND或NDA申請程序,降低重工風險。
延伸閱讀:
4. 法規議題溝通:
國際醫藥法規會隨著不同時間背景而發生變動,RA 需要具備靈敏的法規嗅覺,追蹤最新法規動態,並將其內化轉譯給團隊理解,避免產品開發與製造流程中發生違規事件,導致未來在申請藥證時出現嚴重缺失。同時,當公司的產品遇到審查意見或補件需求時,RA 也需積極與監管機關溝通,確保雙方理解一致,維持良好的合作關係。
5. 確保產品符合法規規範:
從藥品成分、製程、包裝到標示,RA 必須全面審視產品是否符合欲上市國家的法規要求,避免因標示錯誤、包裝不當等問題而被下架或退件。此外,在全球佈局時,RA 更需比對不同國家藥證申請所需的技術文件與審查重點,制定適配的申請策略。
延伸閱讀:



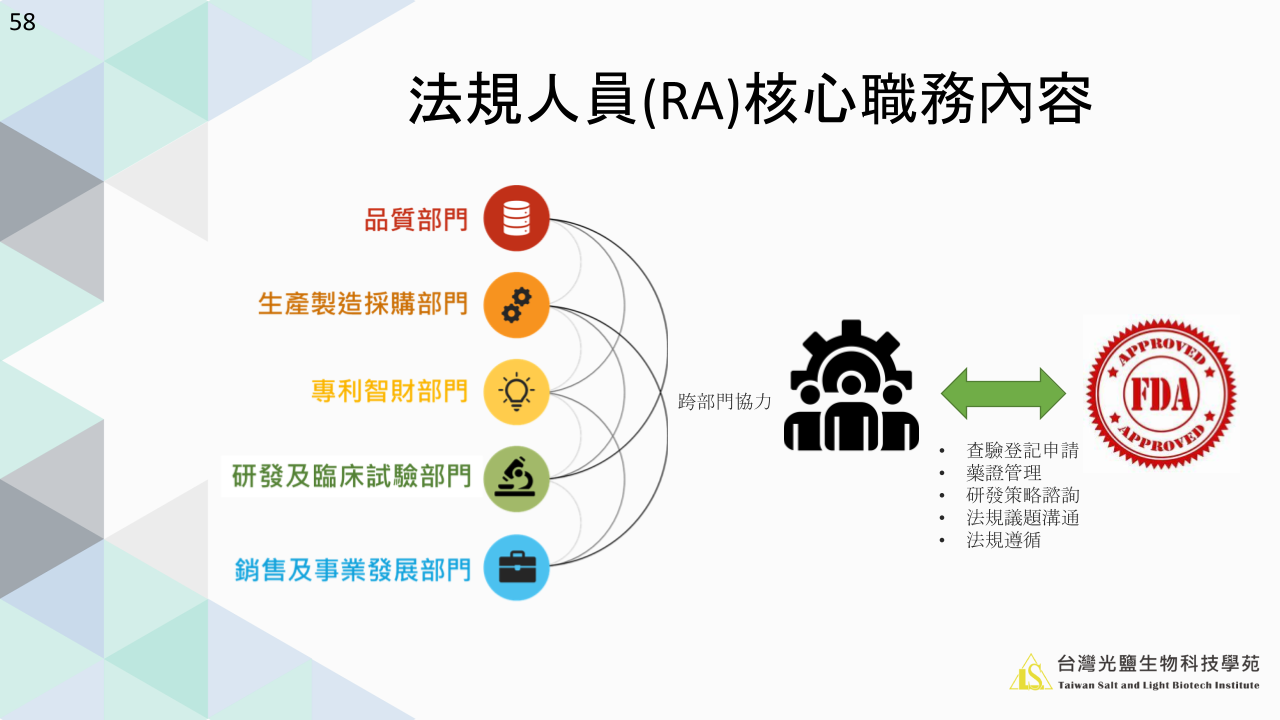
二、法規跨部門溝通協作
在製藥產業中,RA不僅是公司與外部官方監管機構之間的橋樑,對內更需與多個關鍵部門緊密合作。
1. 與品質部門的協作:
- 確保所有分析方法符合法規要求,產出可信賴且可重複的實驗數據,作為未來藥證申請的支持證據。
- 溝通檢驗規格設定,確保產品能達到所指定能放行的品質標準,數據記錄完整且可追溯,以應對未來衛生主管機關的審查。
2. 與生產製造採購部門的協作:
- 監督並協助生產部門落實藥品優良製造規範(GMP),確保在衛生主管機構查廠時無違規情事。
- 當生產線變更或更換原料藥(API)供應商時,需重新評估並確認是否符合法規,並在必要時提出變更申請。
3. 與專利智財部門的協作:
- 評估產品是否涉及專利挑戰,並制定相應的策略,以避免法律糾紛。
- 協調查驗登記與專利挑戰申請時程,避免學名藥侵犯原廠藥專利。
4. 與研發及臨床試驗部門的協作:
- 檢視所提供的研發技術文件是否符合送審規格需求。
- 查驗登記策略佈局時,提前告知研發及臨床試驗部門需要補充哪些試驗或數據資料。
5. 與銷售及事業發展部門的協作:
- 確保所有上市後變更和仿單標籤變更在未經主管機關核准前不得實施。
- 在進行製程放大時,檢視庫存情況,避免因送審導致產品斷貨,影響業績。
延伸閱讀:


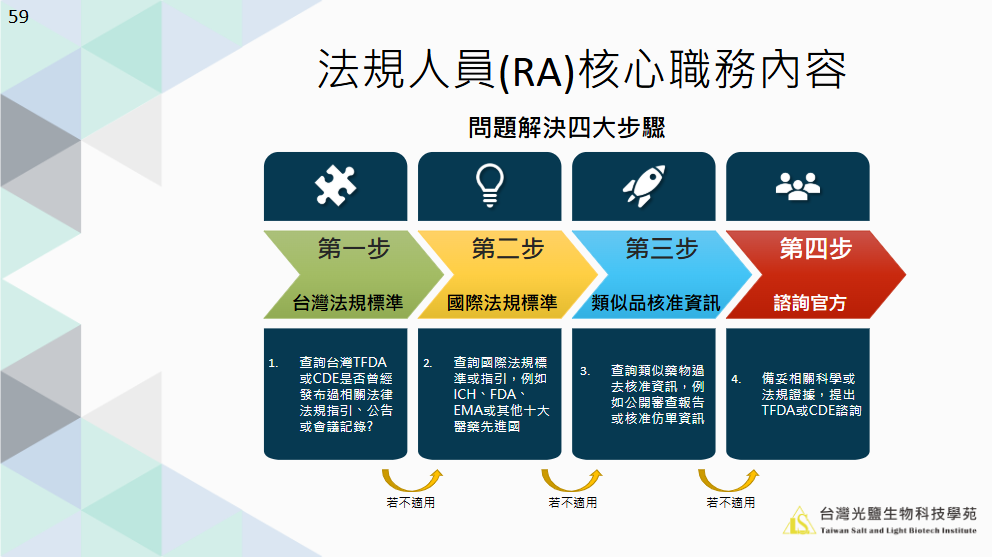
三、藥廠RA面臨法規挑戰的解法
醫藥科技發展日新月異,藥廠法規人員可能會遇到新模態藥物的上市申請、現有產品打入陌生市場等情景,如何在看似無跡可尋的困境中找出一條可行的道路?建議RA人員在面臨複雜的法規挑戰時,採用以下四個步驟,能夠有條不紊地進行分析與應對。
1. 第一步:台灣法規標準
查詢台灣TFDA或CDE是否曾經發布過相關法律法規指引、公告或會議記錄?
2. 第二步:國際法規標準
查詢國際法規標準或指引,例如ICH、FDA、EMA或其他十大醫藥先進國。
3. 第三步:類似品核准資訊
查詢類似藥物過去核准資訊,例如公開審查報告或核准仿單資訊。
4. 第四步:諮詢官方
備妥相關科學或法規證據,提出TFDA或CDE諮詢。
延伸閱讀: