非常感謝 A2雙健維康的總經理 Simon受邀擔任《淺談CRO行業型態與職業發展分享》線上講座嘉賓,吸引超過500人報名參加,收集超過300個提問,報名者多數是想要踏入臨床試驗產業的新鮮人。講座後更是獲得一致的好評,以下整理出講座中的重點,給感興趣但無法前來的人能夠參考一二。
一、CRO的定義及理解
生技藥廠為了降低成本、分散風險,都會將部分工作(例如法規送件、臨床試驗、製劑開發量產等環節)委託給外部公司負責,而這就是CRO產業的商業模式來源。從字面上而言,CRO可以是以下兩種服務類型的縮寫,在定義上有細微的差異:
- Contract Research Organization:顧名思義就是受託研究機構,服務範圍非常廣泛,廣義而言從前期的新藥探索到後期的市場銷售都可以委託處理。
- Clinical Research Organization:受託研究機構的其中一個類型,服務項目以臨床試驗為主。
延伸閱讀:
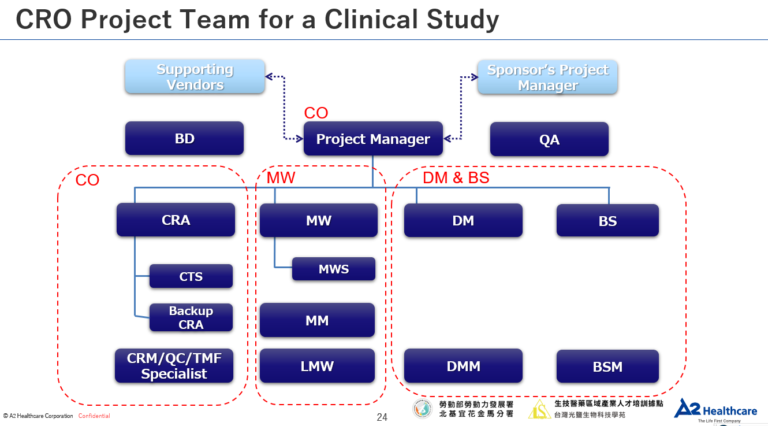
📌CRO公司組織架構及各職務專業分工
📌拆解CRO 一次了解藥物研發「影武者」
📌新藥研發的推手,臨床試驗委託研究機構
二、新藥研發與CRO產業之間的關係(舉例常見的CRO公司代表)
因應受委託的項目不相同,專業分工的結果衍生出不同種類的CRO公司,以下列舉幾個較典型的例子提供參考:
- 製劑開發服務:汎球生物藥劑研發股份有限公司(若是牽涉到委託量產製造,則稱為CDMO)
- 臨床前試驗服務:進階生物科技股份有限公司(主要是做動物試驗,例如藥毒理試驗、生物相容性評估等…)
- 臨床試驗服務:A2 台灣雙健維康生技顧問有限公司 (從試驗計劃書 Protocol 撰寫到臨床試驗報告 Case Study Report 產出)
- 臨床試驗協調管理服務:佳捷生技股份有限公司(提供此服務類型的公司又稱為Site Management Organization,主要負責派遣研究護理師到醫院執行臨床試驗、提供醫院員工臨床試驗教育訓練等…)
延伸閱讀:
📌台灣臨床試驗資訊平台——CRO公司一覽
📌從實驗到上市,一款藥物的開發可以耗費多少青春與成本?
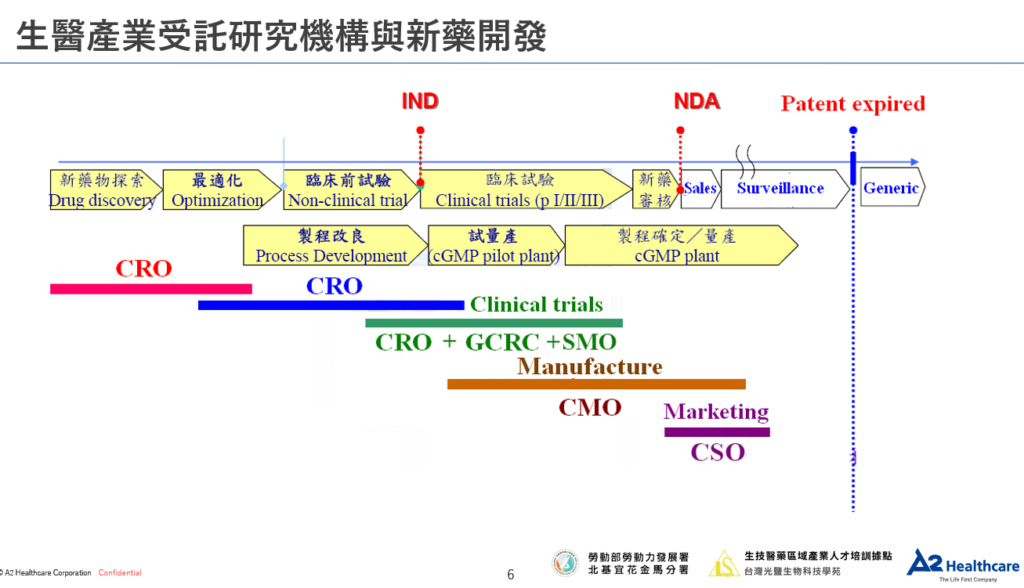
三、CRO公司類型常見歸納法
除了以新藥研發階段去劃分不同類型的CRO公司,我們還可以透過適應症、產品種類、服務範圍、組織結構這4種方式說明大部分CRO公司的類型。
1. 以公司擅長執行的適應症臨床試驗劃分:
- Overall:以台灣市場而言,大部分都是此類型CRO公司,所有適應症都接,不會劃分得太細。
- PK (Phase I), Oncology, Neurology, … :只有國外較大型的CRO才能做比較細緻的劃分,因為市場較大。
2. 以公司熟悉的產品種類劃分:
- Medicine:可分為化學製劑及生物製劑,算是現階段主流CRO公司會負責的領域。
- Medical Device:醫療器材範圍非常廣泛,從軟體到植入式的醫材硬體都包含在此範圍,所以通常會委託給專門在做醫材臨床試驗的CRO公司去負責。
3. 以公司所在的服務範圍劃分:
- Local:據點在台灣本土,與跨國CRO相比沒有完整的SOP及系統,最多只能處理單一國家收案的案子。
- Regional:跨區域的CRO公司,國家跨越度雖不及Global,但還是可以接到小型的多國多中心案子。
- Global:據點遍布全球各地,所接到的案子以臨床試驗三期為大宗,有能力在幾十個國家同時收案。
4. 以公司內部的組織結構劃分:
- Overall:以台灣市場的CRO公司而言,從法規送件到資料統計與分析都一手包辦。
- DM&BS, Regulatory Affair, …:專精於資料統計/分析/法規送件/臨床試驗監測,通常會出現在國外小型的CRO公司。
以上歸類方式可以是互相包含的模式,例如:A2雙健維康公司基本上所有適應症都接、案子以Medicine臨床試驗為主、屬於Regional的CRO公司、組織結構從法規送件到資料統計與分析部門都包含。
新鮮人可以透過觀察一間CRO公司的服務項目、公司規模大小、開缺職務內容等外部公開資訊,快速了解未來會接觸到的業務內容及職業挑戰。
推薦課程:
📌【新鮮人職涯探索】臨床試驗概論及重要參與角色
📌【職業技能學習】臨床試驗專員CRA初階實務培訓班
📌【失待業者轉職專班】藥物開發及臨床試驗從業人員培訓班
四、臨床試驗CRO公司所接的案件類型
不同服務類型會造就不同的CRO公司,就算相同類型的臨床試驗CRO公司也會因應自身規模大小、專業能力各異的情況,所專精的案件類型而有所差異。
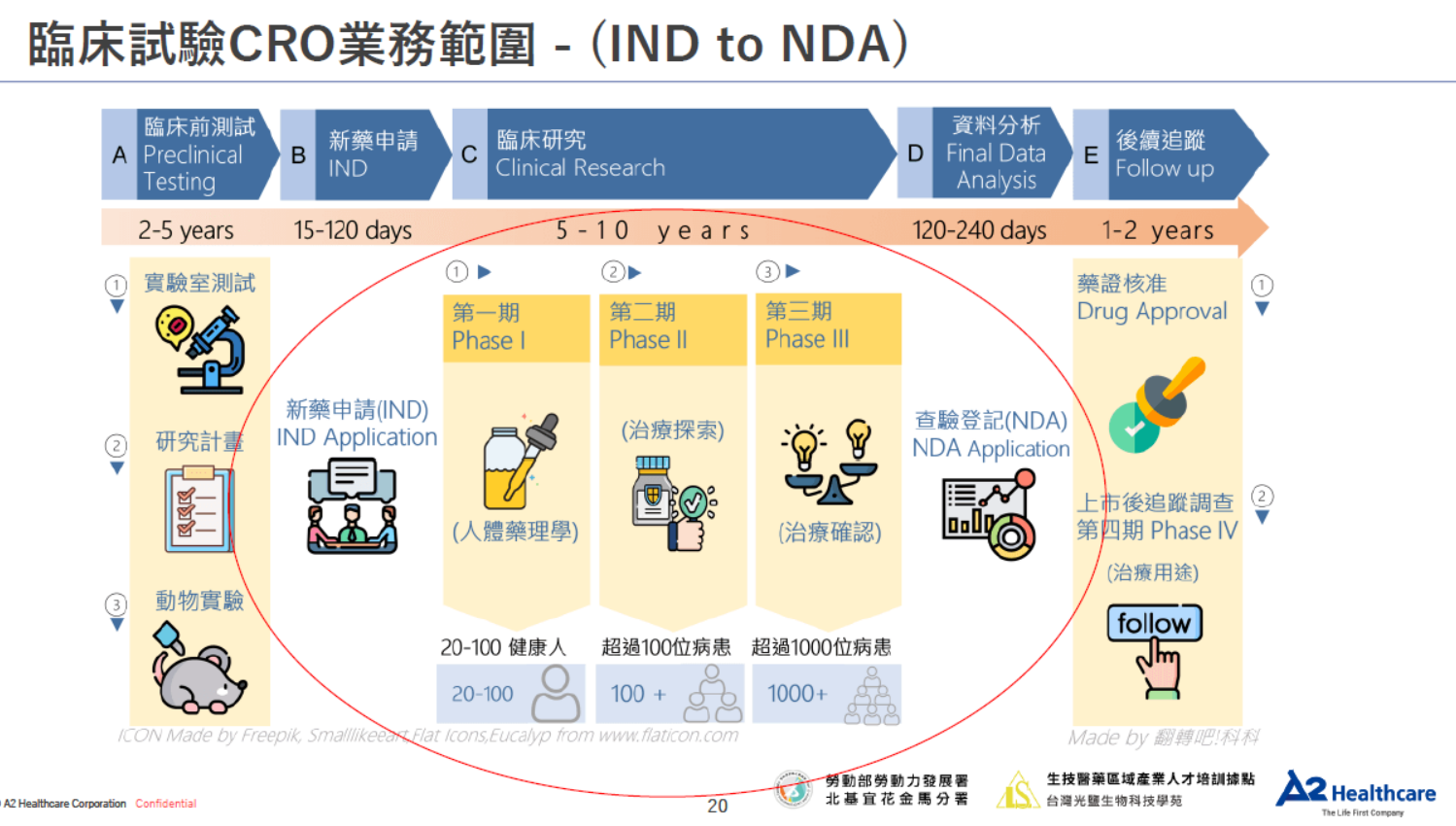
1. 以臨床試驗階段劃分:
- 一般分為Phase 0、Phase I、Phase II (IIa, IIb)、Phase III (IIIa, IIIb)、Phase IV。
- 通常越往後期的臨床試驗會比較需要大型的Global CRO,才比較有能力做多國多中心的試驗執行。
2. 以欲達成目的劃分:
- Research:某些案件目標可能就只是為了發表研究論文,所以在嚴謹程度上會比較低。
- Registration:為了將來的新藥登記而做的臨床試驗,在NDA階段需要符合GCP規範並接受查核。
- PMS:Post Marketing Study上市後監測調查,利用安全性資料進行後續的研究與評估。
- Listing: 試驗用藥已於國內核准上市,但為了進入某醫院處方集之前,被該醫院要求執行的進藥試驗。
- Local CRO接Research、PMS、Listing案件為主,而Global CRO的案件類型則以Registration及PMS居多。
3. 以收案地區劃分:
- Single Center:單一中心收案,以臨床試驗一期為主。
- Single Country Multiple Centers:單一國家多中心收案,以臨床試驗二期為主。
- Multiple Countries Multiple Centers:多國多中心收案,以臨床試驗三期為主。
五、臨床試驗CRO公司未來的發展趨勢及挑戰
從CRO公司領導人的視角出發,以下分享4點目前正在發生改變或未來勢必會成為改革重點的主流趨勢。
1. Risk Management Approaches:
- ICH GCP E6 R2有增加風險管控的部分,以往都要做原始資料驗證 SDV(CRA會拿Patient Binder和EMR電子病歷系統進行相互資料的對比以確保正確性),缺點是是太消耗人力成本。
- 目前的趨勢是針對資料類型去進行系統化分類與處理,進而調整耗費在此階段所需的人力。
值得一提的使在增加風險控管的需求下,CRA需求確實有下降的趨勢,但相對應的資料處理/分析人員 DM & BS的需求是增加的,整體CRO產業的人力需求維持不變,往後對於資料應用尤其是Coding能力應該會更為重視。
2. Real World Data Application:
- 真實世界資料的應用概念,是不是有些試驗不需要對照組,以過往執行過完全匹配的歷史資料為依據。
- 現階段在台灣應用不是太多,因為較完整的對照資料組目前放在健保資料庫中,較難獲得使用權限;另一部分則是各大醫院的病患資料,但也不會輕易釋出給資料處理公司,所以無法找到完全匹配的狀況,只能做參考使用。
3. Electronization/Electronic Process Application:
- 電子化的進展是必然會發生的過程,例如:個案記錄報告、受試者同意書等文件都可以透過電子化處理,數據直接被登錄在系統上,調閱時只需要索引就可以快速查找和比對。
- 目前台灣比較具規模的CRO公司皆已全面完成電子化。
4. Decentralization:
- 大家最常聽到去中心化的概念可能是區塊鏈、NFT等應用,但近年受COVID19疫情的影響,臨床試驗無法在大型的醫學中心執行,因此容許病人在家中視訊看診,後續取藥都不必到醫院。
從以上幾點趨勢中,不難發現臨床試驗CRO公司在努力達成的目的:降低臨床試驗成本、加快收案速度、提高資料準確度。
延伸閱讀:
📌進入CRO的方式及職業發展的成功因素
📌2022 年的臨床試驗趨勢 – Novotech CRO
📌CRO 生物科技產業成功之鑰